Las cuatro leyes de Universo
Hoy os hablaré del libro que lleva por título el del artículo de hoy cuyo contenido se refiere a las cuatro leyes de la termodinámica. Tiene un nivel bastante alto, lo que me lleva a deciros que no lo puedo recomendar si no sois algo especialistas en la materia. Me refiero a tener claros conceptos como entalpía, entropía y tener nociones del ciclo de Carnot. No obstante, si conocéis dichos conceptos, el libro se torna muy interesante y recomendable. Me he animado a comentároslo porque dedica un capítulo a temperaturas negativas y he creído que encontraríais el tema interesante.
Para empezar, el autor da un repaso a las leyes de la termodinámica partiendo del desconocimiento de las medidas macroscópicas (como presión y temperatura), y las va introduciendo en la ley correspondiente. Es bonito ver cómo van surgiendo los conceptos de las leyes de forma “natural”.
Curiosamente, existe la Ley Cero de la Termodinámica. Se llamó así porque la Primera y la Segunda ya estaban estipuladas y era difícil cambiar la numeración. Básicamente dice que si A está en equilibrio con B y B está en equilibrio con C entonces A está en equilibrio con C. Sí, podéis pensar que es una obviedad, pero el termómetro es un aparato que se basa en esta ley. Tenemos un sistema A a cierta temperatura. Ponemos el termómetro B en contacto y vemos que no cambia. Ahora, lo ponemos con C y vemos que tampoco cambia. Concluimos que A y C están a la misma temperatura. Y también, curiosamente, los termodinámicos prestan más atención a los procesos cuando no cambia nada que cuando cambia algo.
Las escalas de medición de temperaturas más conocidas son las Celsius (o centígrada) y Farenheit. La primera debe su nombre al astrónomo sueco Anders Celsius que concibió una escala en la que el agua se congelaba a 0ºC y hervía a 100ºC. El fabricante de instrumentos Daniel Farenheit fue el primero que utilizó mercurio para la fabricación de un termómetro. La temperatura más baja que pudo alcanzar en el laboratorio fue con una mezcla de hielo, agua y sal. A ese punto le puso su 0ºF y para los 100ºF escogió la temperatura corporal. En esa escala, el agua hierve a 212ºF. La gran ventaja que tuvo para aquella época es que no se precisaba de valores negativos para medir temperaturas.
La termodinámica tiene dos enfoques que conviene distinguir: la clásica y la estadística. La termodinámica clásica es la que surgió el siglo XIX antes de que la realidad de los átomos fuera plenamente aceptada y se ocupa de las relaciones entre propiedades macroscópicas.
Hacia finales del siglo XIX, los científicos empezaron a aceptar la existencia de los átomos y surgió la termodinámica estadística que buscaba recuperar las propiedades macroscópicas (insisto: presión, temperatura, etc.) en términos de las propiedades de los átomos que constituían los sistemas como velocidad de la partícula, choque con las paredes, energía de las mismas, etc.
¿Por qué “estadística”?
Mientras la dinámica se ocupa del comportamiento de cada cuerpo por separado, la termodinámica lo hace del comportamiento medio de gran número de ellos. Cuando hablamos de “gran número”, estamos hablando del orden del Número de Avogadro (6’02*1023) partículas y con números tan grandes podemos hacer estadística.
La termodinámica, como gran parte del resto de la ciencia, utiliza términos de uso cotidiano afinándolos de manera que adquieren un significado exacto y no ambiguo. Por ejemplo, todos sabemos que algo que está a 50ºC tiene más temperatura que algo que está a 40ºC, pero ¿qué significa exactamente a nivel molecular que algo esté a 50ºC? ¿Es la temperatura una medida absoluta de algo o es una medida relativa? Y como quiero hablaros de temperaturas negativas, he de definiros qué es temperatura y para ello he de partir de un detalle de la mecánica cuántica.
La mecánica cuántica nos enseña que un átomo puede tener ciertas energías. A temperatura 0 en la escala absoluta (escala Kelvin), todos los átomos estarían en su nivel más bajo, o, mejor, su nivel fundamental de energía. A medida que comunicamos energía al sistema, algunos átomos empiezan a ir a niveles superiores. Comunicamos más energía y más átomos van a niveles superiores. No lo hacen de una forma caótica, sino siguiendo una distribución exponencial. Los cálculos son cortesía del genial teórico Ludwig Boltzmann, y la distribución que siguen los átomos, tal como os la he definido, se conoce como Distribución de Boltzmann.
Un gas es un conjunto caótico de moléculas (de hecho, las palabras “gas” y “caos” provienen de la misma raíz), y es caótico tanto en la distribución espacial de las mismas como la distribución de sus velocidades. Cada velocidad se corresponde con una energía cinética dada y se puede utilizar la distribución de Boltzmann para expresar la distribución de estas velocidades y relacionar dicha distribución con la temperatura.
La expresión resultante se llama Estadística de Maxwell-Boltzmann, ya que fue James Clerk Maxwell el primero que la dedujo de una forma ligeramente diferente. Cuando se hace este cálculo encontramos que la velocidad media de las moléculas crece con el cuadrado de la temperatura absoluta. Podemos pensar, entonces, en la temperatura como en una medida de la velocidad media de las moléculas de un gas. Temperaturas altas corresponden a velocidades medias altas y temperaturas bajas a velocidades medias bajas.
A medida que se aumenta la temperatura de un gas, las poblaciones de moléculas se desplazan a estados de mayor energía, o sea, que cada vez serán más las moléculas que se mueven más vigorosamente. En el caso de un sólido lo que sucede es que las moléculas, atrapadas en su posición, vibran con mayor vigor en torno a sus posiciones de equilibrio. Agitación y temperatura son conceptos similares.
No confundir temperatura con calor. El calor, en lenguaje cotidiano, fluye de un cuerpo a otro. En termodinámica, el calor no es un ente, ni siquiera una forma de energía: el calor es un modo de transferencia de energía en virtud de una diferencia de temperaturas.
Existe un equivalente entre trabajo y calor. Aun así, son cosas diferentes. Para empezar, existen calentadores y no trabajadores. Cuando levantamos un bloque hacemos trabajo sobre él. Todos los átomos se moverán en la misma dirección y sentido de manera uniforme. Lo mismo sucede al comprimir o estirar u muelle. Por tanto, el trabajo es la transferencia de energía mediante el movimiento uniforme de los átomos en el medio.
Ahora bien, si ponemos en contacto un bloque de hierro caliente con otro frío, los átomos del bloque caliente oscilan con mayor vigor y empujarán a los átomos del bloque más frío que vibran con menor intensidad. Los átomos del bloque más frío empezarán a moverse con mayor vigor, justo al contrario que los del bloque más caliente. No obstante, ninguno de los bloques se moverá al ponerlos en contacto, pues los movimientos de las moléculas que los componen son aleatorios. Por tanto, el calor es la transferencia de energía mediante el movimiento aleatorio de los átomos en el medio.
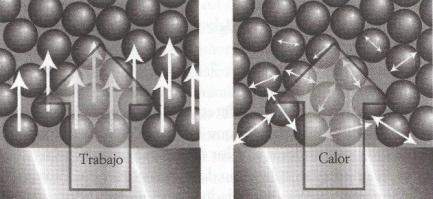
Esta diferenciación molecular entre calor y trabajo aclara un aspecto del nacimiento de la civilización. El fuego, el suministro caótico de energía, es fácil de conseguir ya que el desorden no está sujeto a restricción alguna. El trabajo es una energía más domesticada y requiere mayor refinamiento. Por ello, la humanidad se topó rápidamente con el fuego, pero necesitó milenios para llegar a la máquina de vapor, el motor de combustión interna y el reactor.
Los átomos pueden moverse de diferentes maneras: desplazándose, rotando o vibrando. Los niveles de energía de traslación están tan próximos que prácticamente es un continuo. Los niveles de rotación en los gases están bastante separados. Los niveles de energía vibracional (asociados a la oscilación de los átomos en las moléculas) están muy separados.
Esta es la razón de por qué cuando se calienta un gas las moléculas se excitan fácilmente (es decir, se mueven más deprisa) y, en todos los casos prácticos, se propagan por muchos estados rotacionales. La energía interna del sistema se aumenta y sube la temperatura. En un sólido, las moléculas no pueden desplazarse ni rotar: sólo pueden vibrar. En los líquidos y en los gases el movimiento molecular está menos restringido que en los sólidos y por ello tienen más capacidad de absorber calor.
El agua tiene una capacidad calorífica muy alta, lo que significa que para calentarla se requiere mucha energía. Pero esto conlleva otra ventaja y es que tal y como es capaz de absorber la energía, también es capaz de almacenarla. Es por ello que es un buen medio para los sistemas de calefacción central y es por ello que los océanos se calientan y enfrían despacio, con la importancia que tiene para el clima de nuestro planeta.
Hoy, las menores temperaturas alcanzadas son 10-10K para los sólidos y 5*10-10K para los gases. Con estas temperaturas las moléculas se desplazan tan despacio que en 30 segundos recorren una distancia de 2,54 cm.
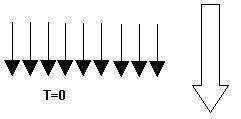
Supongamos que tenemos un sistema con una serie de spines (podemos imaginarlo como si fueran agujas imantadas). Sería un sistema en el que las moléculas sólo tienen dos estados: el estado up (el estado de mayor energía que representaremos una flecha hacia arriba “↑”) y el down (el estado de menor energía que representaremos con una flecha hacia abajo “↓”). Los spines, al someterlos a un campo magnético externo, tienden a alinearse con él. Vamos a suponer (y sólo suponer) que estamos a temperatura 0 y ponemos un campo magnético orientado hacia abajo:
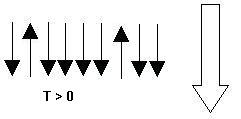
Ahora supongamos que comunicamos energía al sistema. Entonces, algunos de los spines tendrán la suficiente como para poder vencer al campo magnético y alinearse en contra del mismo:
Y ahora suponed que comunicamos mucha temperatura (idealmente, infinita). ¿Cuál será el estado final? ¿pensáis que será este?:
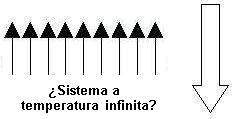
Pues no. La segunda ley de la termodinámica nos dice que habrá aproximadamente la misma cantidad de spines up y de spines down. ¿Por qué deberían alinearse todos en un solo sentido? Si tienen energía de sobras, podrán estar, por así decirlo, en la posición que les plazca y como ya os dije, la tendencia es a ir hacia el estado que encontraremos con mayor probabilidad. Y es que, si todos se mueven como les place, lo lógico será encontrar la mitad up y la mitad down. Técnicamente hablando: cuando la temperatura es infinita, todos los estados están igualmente poblados.
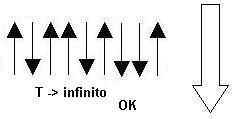
Bien, dicho esto, queda una pregunta en el aire: ¿cuál es la temperatura de un estado como este?
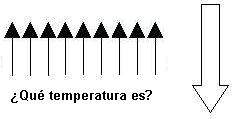
Pensad que ya hemos cubierto el rango entre 0 e infinito y este estado no estaba en dicho rango. Recordad que habíamos dicho que según aumenta la temperatura se poblaban los niveles de mayor energía desde los de menor; pero en este caso, tenemos los niveles altos poblados y los niveles bajos vacíos. Pues bien, la respuesta es que, tal y como hemos definido temperatura, esta disposición de spines tiene temperatura negativa.
En la práctica, el concepto temperatura se aplica a sistemas como estos que tienen dos niveles posibles de energía. Se logra alineando todos los spines con el campo magnético y cuando están bien ordenaditos, se lo cambiamos de golpe. Los spines son perezosos y les cuesta moverse. Lo que hacemos así sería pillarlos “fuera de juego”. Estos mismos principios son aplicables a otros gases cuyas moléculas tienen tres o más niveles de energía. Lo que sucede es que son estados forzados y no se mantienen así mucho tiempo. Os invito a que meditéis todas estas ideas con calma.
Y no penséis que no tenéis temperaturas negativas cerca. Sabed que si tenéis un reproductor de CD o DVD que tenga un láser, trabaja con temperaturas negativas absolutas. El principio del láser es tener muchos átomos o moléculas en un estado excitado de energía y esa es la definición que hemos dado de temperatura negativa. Sobre el láser, si queréis, podemos hablar en alguna otra historia.
Este libro, aunque corto en páginas (unas 140), es muy recomendable y entretenido para el especialista.

Título: “Las cuatro leyes del Universo”
Autor: Peter Atkins











El día 7 de octubre de 2008 a las 01:05
“Cuando hablamos de “gran número”, estamos hablando del orden del Número de Avogadro (6′02*12-23) partículas y con números tan grandes podemos hacer estadística.”
Pufff, incluso el número de Avogadro ha sido uno de los “índices” afectados por la caída de la bolsa en Wall Street! Ahora registra una potencia negativa a la -23!
El día 7 de octubre de 2008 a las 01:58
Me parece que a ud le falta informacion.
El día 7 de octubre de 2008 a las 03:40
Y esto no se salta la tercera ley de la termodinámica? (sí, ya sé que no, pero quiero saber dónde está la “trampa”) Será como eso de “científicos logran superar la velocidad de la luz, cuando en realidad son cosas de la velocidad de grupo y demases?
Saludos
El día 7 de octubre de 2008 a las 08:18
Marfil: ¡Y yo sin enterarme!
tercera Ley dice que no es posible alcanzar el cero absoluto a través de procesos cíclicos. Mi proceso no era cíclico  Por otro lado, respeta el resto de las leyes y el libro hace un repaso de las mismas. Lo que digo es real y me lo explicaron en Física Estadística. Lo tengo en mis apuntes y conocía el tema, de ahí que quisiera explicarlo.
Por otro lado, respeta el resto de las leyes y el libro hace un repaso de las mismas. Lo que digo es real y me lo explicaron en Física Estadística. Lo tengo en mis apuntes y conocía el tema, de ahí que quisiera explicarlo.
raul: ¿y quién lo sabe todo?
Dicari: No se la salta. La
Salud!
El día 7 de octubre de 2008 a las 11:03
Si la velocidad máxima para un átomo es la de la luz, también debe haber una temperatura máxima, pero no consigo encontrar información de ello, ¿Sabes a que se debe?
El día 7 de octubre de 2008 a las 11:09
Malonez: no debes hablar de velocidad máxima sino de energía máxima. La temperatura no es directamente la velocidad de las partículas, sino la energía que tienen
Salud!
El día 7 de octubre de 2008 a las 11:28
Insisto en lo que dice Marfil, has puesto mal en número de Avogadro, en vez de 6,02*10^23 has puesto 6,02*10^-23
El día 7 de octubre de 2008 a las 11:33
Eneko: ¡ahora!
Gracias.
Salud!
El día 7 de octubre de 2008 a las 14:29
Solamente una pequeña corrección. El siguiente párrafo tiene un error bastante habitual:
“Las escalas de medición de temperaturas más conocidas son las Celsius (o centígrada) y Farenheit. La primera debe su nombre al astrónomo sueco Anders Celsius que concibió una escala en la que el agua se congelaba a 0ºC y hervía a 100ºC.”
Lo de la negrita no es del todo correcto. En un primer momento, Celsius dijo que el agua hervía a 0ºC y se congelaba a 100ºC (a presión atmosférica en el mar blablabla…). Vamos, al revés que ahora. Fue el gran Lineo (sí, el biólogo) el que dos años después dio la vuelta al asunto, dejándolo como hoy está.
Vamos, que Celsius si inventó la escala y los límites superior e inferior, pero la escala que hoy conocemos se debe a Lineo.
http://en.wikipedia.org/wiki/Celsius#History
(lo siento, no sé enlazar)
El día 7 de octubre de 2008 a las 15:17
Algunos apuntes:
- Hablando en plata no rompes la 3ª ley porque no llegas a temperaturas negativas pasando por cero sino rodeando por infinito.
- Sobre la escala Fahrenheit existen varias teorías:
Sobre el 0 que bien fue el ensayo con sal o la temperatura más baja de aquel invierno en su casa.
Sobre el 100 parece claro que era temperatura corporal pero teniendo en cuenta que son 38ºC existen dos teorías, o tenía fiebre o realmente midió la temperatura corporal… pero de su caballo.
El día 7 de octubre de 2008 a las 15:51
No acabo de entender el significado físico de la temperatura negativa.
¿Si tuviéramos un termómetro en ºK i midiésemos la temperatura de un estado de esos marcaría negativo?
El día 7 de octubre de 2008 a las 17:59
“la velocidad media de las moléculas crece con el cuadrado de la temperatura absoluta. Podemos pensar, entonces, en la temperatura como en una medida de la velocidad media de las moléculas de un gas”
Pues sigo pensando que si hay una relación entre velocidad y temperatura, tiene que existir una temperatura máxima debido al límite de la velocidad de la luz. A no ser claro, que a cierta temperatura deje de funcionar este concepto o no funcione en todos los supuestos.
Si no aumenta en velocidad, ¿aumenta en rotación? Estamos en las mismas. ¿Vibra más? Bueno, como mucho a la velocidad de la luz y si la amplitud de la vibrac¿Suben de nivel los electrones? Llegará un momento que se escaparán del átomo y por tanto ya no podrán subir más. Algo se me escapa, esta claro.
El día 7 de octubre de 2008 a las 22:47
Muy buen artículo!
No sé nada de termodinámica, pero aprendí mucho…
Siempre me intrigó eso de 0°K, así que esto de temperaturas negativas me supera totalmente! Igual me suena a que es algo más de convención que temperaturas realmente negativas.
El día 7 de octubre de 2008 a las 23:58
Hermes: buena puntualización. Lo corrijo. Gracias.
chemist: exacto. Y tampoco rompes la segunda, porque si dejas un sistema a temeratura negativa eolucionar, su entroía también aumenta.
Toro Sentado: ufff, esto requiere una explicación.Cuando mides algo, lo que haces, en realidad, es mirar las consecuencias de ese algo. Cuando pones un termómetro de mercurio, sabemos que su volumen aumenta con la temperatura y de ahí que lo utilicemos cotidianamente. Pero como quieras medir la temperatura del ntrógeno líquido… el mercurio se te congelará. Para medir nitrógeno líquido se utiliza un material del que sabemos que su resistencia cambia con la temperatura. Hacemos pasar una corriente y midiendo esa resistencia podemos saber la temperatura y los cambios a esas escalas. Para medir las temperaturas negativas necesitaríamos un dispositivo que nos diera los estados de los átomos. Cuantos más hubiera en estado excitado (por encima de la distribución de Boltzmann), más negativa sería la temperatura. Pero más que centrarte en pensar qué es una temperatura negativa, piensa en el sistema de spines que he puesto en el artículo e intenta cuadrar la definición de temperatura para los diferentes estados. No sé si contesto a tu pregunta.
Malonez y Manu: os digo lo mismo que a Toro Sentado. Una cosa es lo que tengáis en vuestra intuición sobre qué es temperatura y otra cosa es darle una definición exacta. En el ejemplo de los spines, no hay velocidad, no hay rotación ni vibración. Es un sistema (imaginad que hubiera muchos spines) al que hay que definir concepto temperatura. No es fácil; pero está claro que desde 0 a infinito, no contemplamos todas las posibilidades de cómo puede estar el sistema.
Os invito a que penséis en temperatura no como lo que sentís en vuestros cuerpos, sino en que dada una serie de partículas con sus características, físicas, defináis temperatura. Por ejemplo, el sistema de los spines
Pensadlo y las dudas que os vayan surgiendo, las preguntáis. Es un tema muy curioso.
Salud!
El día 8 de octubre de 2008 a las 01:27
Mm a ver…Puedo llegar a temperaturas negativas siempre que no sea pasando por el cero? Siempre que no sea un proceso cíclico? Tendré que estudiar más
El día 8 de octubre de 2008 a las 02:18
Se entiende la parte “física” del tema, como el que no viole las leyes de la termodinámica, aunque hay algo que no me queda claro en cuanto a la tercera ley:
¿En el cambio de temperatura positiva a temperatura negativa si se esta alcanzado eventualmente los 0ºK gracias a que no se está usando un proceso cíclico, sino se esta cambiando el campo magnético de golpe?
¿O lo que se está diciendo es que el cambio de positivo a negativo nunca pasa por cero? Si es esto último si quedo hecho un lío. :S
El día 8 de octubre de 2008 a las 11:36
No hace falta un número de avogadro para aplicar la mecánica estadística, puesto que se aplica sobre NIVELES DE ENERGÍA y no sobre componentes. Esto hace que podamos aplicar la mecánica estadística sobre un átomo encerrado en una caja (1 sólo componente, MUCHÍSIMOS niveles de energía).
El día 8 de octubre de 2008 a las 12:34
Con respecto a lo del límite superior de temperatura os facilito un enlace que puede resultar interesante.
eltamiz.com/2007/04/14/¿existe-un-limite-superior-de-temperatura/
El día 8 de octubre de 2008 a las 18:05
Omalaled , esto de la temperatura negativa tiene algo que ver con el condensado de Einstein-Bose???
Me he agarrado un lio barbaro y no consigo terminar de entenderlo, asi que ahora te suplico que lo expliques de otra manera. No consigo entender como puede tener temperatura negativa. Que mediria un termometro Kelvin en estas circunstancias???
El día 8 de octubre de 2008 a las 18:42
Acabo de recibir el libro que comentas pero todavía no lo he leído así que me alegro que te haya gustado.
Te recomiendo del mismo autor “The periodic kingdom” (ignoro si está traducido). En él Atkins habla de la tabla períodica y sus elementos como si de un país se tratara. El primer capítulo es sobre “geografía” y trata de las propiedades periódicas (y su representación gráfica, que asimila al relieve del “país”). El segundo capítulo es de “historia” y habla sobre la historia y nombre de los elementos. El tercer y último capítulo es sobre “política” y trata del átomo y las relaciones entre los elementos. Lo leí hace varios años y lo encontré muy entretenido.
El día 8 de octubre de 2008 a las 18:56
Gracias por las explicaicones omalaled, sin embargo gracias al enlace de todo_spam parece que efectivamente hay un límite para la temperatura…
http://es.wikipedia.org/wiki/Temperatura_Planck
Lo cual significa además que no llegamos a temperaturas negativas desde el infinito porque hay un límite, ¿no? ¿Para llegar a una temperatura negativa vamos a dar “un salto” en su valor (no derivable)?
El día 8 de octubre de 2008 a las 23:50
Dicari: hazlo… que cuando seas como yo lo recordarás con nostalgia
 Me alegra que así sea.
Me alegra que así sea.

Marfil: sí, lo has visto bien. El cambio hacia una temperatura negativa no es un cambio gradual sino que se hace de golpe. En el sistema de spines pasábamos de golpe y de una sola tacada. Así es.
unodetantos: juegas con ventaja
todo_spam: reconoco que lo desconocía. Ya tenemos distancia de Planck, tiempo de Plank … y muchas más cosas de Planck. tengo un libro en casa de él que veo que tendré que desempolvar
Cesar: lo explicaré tantas veces como vuestra curiosidad quiera. La temperatura, coloquialmente, es una sensación de calor. Pero termodinámicamente hemos de relacionarla con las propiedades microscópicas de nuestros sistemas. En el caso de un gas hablamos de velocidad y energía de las partículas, estados vibracionales, etc. Estas características siguen una distribución de Boltmann. Ahora imagina que forzamos esa distribución a un estado que por sí sola no podría llegar (técnicamente, la probabilidad es muy pequeña). El caso de los spines es claro. Todos alineados a favor del campo magnético tenemos temperatura cero. La mitad up y la mitad down tenemos temperatura “infinita”. ¿Qué temperatura tiene el estado en que todos están en contra? Ya nos hemos comido la escala del 0 al infinito
Por otro lado, el concepto termómetro es otra cosa que hay que apartar de nuestra mente como prejuicio. Un termómetro de mercurio no es más que un líquido que se expande y contrae en función de las propiedades termodinámicas del sistema que le rodea. Pero no olvidemos que no mide temperatura, sino que su comportamiento es consecuencia del sistema termodinámico. Como decía antes, ¿cómo medirías la temperatura del nitrógeno líquido? Un termómetro de mercurio se te congelaría y no creo que encuentres (o quizá sí) sustancia con la que puedas hacer una medida. Ahora bien, sabemos que ciertos materiales varían resistencia en función de su temperatura, así que ponemos uno de esos materiales, le hacemos pasar una corriente y medimos su resistencia. De ahí deducimos la temperatura; pero no lo olvidemos: estamos midiendo la resistencia de un material.
Con los spines bastaría un mecanismo que detectara el número de partículas con el spin up; podría ser un medidor de campo magnético o a saber. El “termómetro Kelvin”, no existe.
Lo del condensado de Bose Einstein es otro cantar. Es cuando un gas de bosones (ufff, en otro momento, ¿vale?) tiene todas sus partículas en el estado fundamental. Tiene unas propiedades increíbles, que sólo son previstas por la cuántica y, de hecho, allí se manifiestan muchos efectos cuánticos. Tiene algo de relación en cuanto se refiere a mecánica estadística (cuántica en el caso del condensado de Bose-Einstein).
No sé si aclaro o lo pongo peor. Pero si quieres saber más, aquí me tienes
laura: tomo nota de esos libros de Atkins. Seguro que los leeré. Gracias.
Malonez: es correcto lo que dices. El error está en pensar “de forma clásica” en la temperatura negativa. Un sistema no desciende al cero y empieza a ascender, sino que da un salto. Las fórmulas termodinámicas clásicas no son de aplicación directa. Lo que sí cumplen es con todos los principios de la termodinámica (conservación de energía, aumento de entropía, etc.). De esos no se libran.
Salud!
El día 9 de octubre de 2008 a las 01:32
Hola a todos!, creo q se aclara todo pensando en términos de entropía. El estado con todos los espines hacia abajo (el de mínima energía) tiene entropia 0 (solo hay un microestado posible->todas las partículas con spin en dirección al campo magnético). El estado de máxima energía, en este caso también tiene entropía 0 ,(todos los espines en dirección contraria al campo). Por definicion la temperatura = 0 está cuando la entropía es 0. Ahora imaginar los estados clasificados según su entropía dentro de una circunferencia, en el polo sur están los estados con entropía 0 (el de máxima y mínima energía), en el polo norte está el estado de máxima entropía (cuando exáctamente hay el mismo número de espines arriba y abajo). A medida que “damos” energía al sistema (calor) nos desplazamos a saltos por la circunferencia en sentido opuesto a las agujas del reloj (el sentido es lo de menos) hasta que llegamos al polo norte (máxima entropia), en este período de saltitos nuestro sistema ha ido aumentando su temperatura. Cuando suministramos un poquito más de calor, damos otro saltito en sentido opuesto a las agujas del reloj en torno a la circunferencia, es decir, pasamos a un estado de mayor energía y menor entropía!!!, por lo tanto se ha producido una variación negativa de la entropía suministrando una cantidad “positiva” de calor, esto implica q el estado alcanzado tiene una temperatura negativa (a grosso modo para q se cancelen los signos menos a ambos lados de la ecuación) , si continuamos suministrando energía cerraríamos la circunferencia alcanzando de nuevo el estado de entropia=0 (estado de máxima energía) y por lo tanto de temperatura 0.
Os pongo números (inventados) de temperatura y entropía que se irían dando a medida que suministramos calor:(entropía, temperatura).
(0,0),(5,20),(10,40),(15,60),(10,-40),(5,-20),(0,0)
el (0,0) inicial corresponde al estado de mínima energía, el (15,60) corresponde al estado de máxima entropía, el estado final (0,0) corresponde al estado de máxima entropía (todos los espines en contra del campo magnético; este sería un estado metaestable).
Espero que esto ayude a entenderlo.
un saludo a todos los que comentan en este blog, vuestros comentarios son un complemento perfecto a la historia.
Gracias por tu blog, me encanta.
un saludo, Orlin.
El día 9 de octubre de 2008 a las 11:49
omaled, ahora te falta un articulo largo de explicar bien lo de los spin.. ^^ que tambien son bastante anti-intuitivos cuando los espines 3/2 y esas cosas…
Un abrazop, Nachop
El día 9 de octubre de 2008 a las 20:59
Uffff, me ha superado completamente. He buscado en la red y encontre esta explicacion, pero asi y todo me desborda totalmente. Pero no me dare por vencido, seguire intentando.Muchas gracias omalaled por tu paciencia con nosotros los profanos!!
http://disneydrow.wordpress.com/2008/05/19/temperaturas-negativas-bajo-cero-kelvin/
El día 10 de octubre de 2008 a las 01:49
orlin: muchas gracias. En la explicación que das, hay algo que es así (puede que haya sido mala interpretación mía) y es que consigues temperatura negativa a base de dar más y más energía. No es así. Dando más y más energía llegas a temperatura infinita (entropía máxima). Para llegar a temperatura negativa necesitas una discontinuidad.
Nachop: cada día me lo ponéis más difícil
Cesar: la paciencia la tenéis vosotros conmigo por leer estos ladrillazos. Relee ese buen enlace que has puesto un par de veces más y luego el artículo. Mira los dibujos del post e intenta razonarlo por ti mismo. Y, no te preocupes si no puedes entenderlo: hay temas en física que son para volverse loco. Por lo menos, si alguna vez lo oyes te sonarán campanadas.
Salud!
El día 10 de octubre de 2008 a las 11:50
Hola Omalaled, dije que alcanzas el estado de máxima entropia (mismo número de espines hacia arriba q hacia abajo)dando más energía al sistema. También dije que el paso de ese sistema de entropía máxima al sistema en el que hay N/2 +1 espines hacia arriba,N/2 -1 espines hacia abajo, que tiene menor entropía q el anterior y más energía, se llega suministrando más energía al estado de máxima entropia, tienes razón, no creo q sea eso lo q le hace pasar de un estado a otro, sino que haya q hacer algún tipo de trabajo (manipular un espin y pasarlo de estado abajo a estado arriba). Tengo q pensarlo.
saludos!!!
El día 10 de octubre de 2008 a las 12:23
Hola, soy el pesado de la temperatura máxima. Una vez más insisto en mi idea. Dada la definición de temperatura a partir de la constante de Boltzman http://es.wikipedia.org/wiki/Temperatura_absoluta y sustituyendo la velocidad por la de la luz (límite máximo) llegamos a la temperatura máxima, que es la temperatura de Plank (que puse anteriormente). Por tanto si llegas a esa temperatura y agregas energía consigues que, wikipedia dixit, se “rompan” las partículas y vuelvan al estado inicial del Big Bang.
El día 10 de octubre de 2008 a las 16:59
Malonez, quizá venga a cuento lo que descubrió Einstein: una partícula que aumenta su velocidad también aumenta simultáneamente su masa. Con velocidades bajas el aumento de masa es pequeño, pero cuanto más nos acercamos a la velocidad máxima (la de la luz), mayor es la fracción de la energía gastada que se convierte en masa de la partícula y menor el aumento de su velocidad.
El día 11 de octubre de 2008 a las 11:21
Rawndi, tienes mucha razón, pero el efecto que dices se produce por trabajo, no por calor. Vamos, eso creo
El día 11 de octubre de 2008 a las 20:28
El nombre de “temperatura negativa” es un convencinalismo (podría habersele puesto “supertemperatura” o cualquier otra cosa). No significa que sea una temperatura MENOR al cero absoluto. Significa que es un estado de energía diferente. Nada mas.
El día 11 de octubre de 2008 a las 22:47
Daniel: no, no es así. Léete este artículo que recomendaron antes. Sobre todo en la parte donde habla de la Ecuación de Boltzmann. No es un convencionalismo: es temperatura negativa.
Salud!
El día 12 de octubre de 2008 a las 22:22
Dos comentarios:
1) Lo que dices de la situación con los spins y el campo magnético no es cierto. Casualmente acaba de salir un paper diciendo que casi todos los libros de Resonancia Magnética Nuclear plantean eso, y que está mal. El único libro que lo explica bien es el de Levitt, llamado Spin Dynamics. Es un error muy común. Los spins no están up o down, sino en un estado mezcla, incluso en el caso de poner un campo magnético.
2) Lo de la temperatura negativa es difícil de entender. Se vé mejor mirando la exponencial de la ley de Boltzmann. Es más, la temperatura más grande sería -0. Es decir, un número muy cercano a cero viniendo de los negativos. Si haces las cuentas con un cuerpo a temperatura negativa en contacto con uno a temperatura positiva, te dá que el calor fluye del negativo al positivo.
Saludos
El día 13 de octubre de 2008 a las 00:50
“Esta diferenciación molecular entre calor y trabajo aclara un aspecto del nacimiento de la civilización. El fuego, el suministro caótico de energía, es fácil de conseguir ya que el desorden no está sujeto a restricción alguna. El trabajo es una energía más domesticada y requiere mayor refinamiento. Por ello, la humanidad se topó rápidamente con el fuego, pero necesitó milenios para llegar a la máquina de vapor, el motor de combustión interna y el reactor.”
Para no ser tan negativos como algunos :-P, me quedo con este párrafo, me resulta un tanto poético y el menos científico de todo el artículo, quizá por ello me resulte poco creíble.
No era tan complicado al fin y al cabo omalaled… bueno sí que lo era. Lo que ocurre es que sintetizas muy bien. Poco importa a los profanos que entendamos los principios por los que discutís, sino que un avance, un descubrimiento sienta la base para alcanzar el siguiente, y así una y otra vez hasta el ¿infinito?.
La poca ciencia que leo no es por ella en sí misma, sino por su evolución, la historia de los descubrimientos es lo que verdaderamente me atrae.
Saludos y seguiré atento a los ladrillos
El día 13 de octubre de 2008 a las 18:15
Precisamente lo comentado por PECE también es la parte que más me llamó la atención. Una especie de frase genial – resumen perfecta.
Por qué no habría este blog cuando hice la carrera? (En fin, en realidad, apenas había Internet) Cuantos sinsabores me produjo la mec. estadística (siempre achacables a los malos docentes claro). Y aquí la liquidas en 9 minutos y 9 segundos de lectura.
También es cierto que por entonces el señor éste, el Peter Atkins, sólo escribía libros de Física-Química. Bastante sencillos, la verdad. Y ahora le da por la divulgación (y por patrocinar a Richard Dawkins, el muy ateo ).
).
Por cierto, a mí me incomoda particularmente la aclaración que pones entre paréntesis para significar que escala Celsius y centígrada es equivalente. Oficialmente se llama escala Celsius y grado Celsius. Total, también la escala Kelvin o absoluta es centígrada.
Acabo de leer en la Wikipedia que así se evita la confusión con el grado centígrado de los ángulos; la primera vez que escucho esto.
El día 14 de octubre de 2008 a las 17:17
Muy bueno como siempre Omalaled, pero he de confesar que con este artículo me has superado por completo. Le sigo dando vueltas al concepto de temperatura absoluta negativa y, por más que leo los enlaces dado, no consigo que me entre.
No cejaré en el empeño, pero esta vez no te prometo nada
El día 15 de octubre de 2008 a las 00:12
No os sepa mal que no lo entendáis. Muchas veces, estos conceptos necesitan mucho tiempo para ser asimilados y necesitan una base que también se gana con el tiempo.
Lo que sí me gustaría es que, los profanos en la materia, os plantearais qué es para vosotros temperatura, por qué un termómetro la mide, qué es presión. En otras palabras, que penséis de dónde salen las medidas macroscópicas a partir de las medidas de cada molécula que compone un gas.
Si he conseguido que penséis en ello, ya me doy por satisfecho.
Por cierto, Lichi: tienes razón en lo de los spines. La cuántica es para volverse loco.
Salud!
El día 10 de noviembre de 2008 a las 19:01
O_o tengo que entenderlo… Más o menos lo entiendo pero sólo lo imagino y se me olvida toda la terminología que usan jajaja
El día 10 de noviembre de 2008 a las 19:51
Olas! Excelente espacio, me encanto. Eso de las temp negativas ta medio raro, pero checare un poco mas sobre el tema =)
Disculpa, tengo dos dudas de un tema ke escribiste hace ya un buen rato: los agujeros negros.
1.- Con eso de las particulas virtuales… “la materia no c crea ni c destruye” es una mentira?
2.- Por lo de la radiacion de Hawking… si aparecen un electron y un positron a los diferentes lados del horizonte de sucesos y por consiguiente el agujero negro c lleva a uno… no c supone ke por el hecho de ke cargas opuestas se atraen ambas particulas c irian hacia al agujero negro?
Muchisimas gracias! Muchas felicidades por el sitio =)
El día 22 de julio de 2009 a las 21:40
h0la muii liind0 spacii0 me re gust0 i enc0ntre l0 qe buscaba grax! =)
El día 28 de abril de 2010 a las 04:13
necesito saber las otras tres leyes xk solo encontre una k es la tercera
El día 2 de mayo de 2011 a las 23:22
hola yo estudio bachiller en ciencias en una de las mejores escuelas de la ciudad de Panamà y unas de mis materias es fisica estadistica y me gustaria que algunos de uds me explicara ya que me interesa el tema…..GRACIAS Y SALUDOS