El modelo de Bohr
La física clásica no funciona. Por no funcionar ni siquiera explica la estabilidad de la materia. Hubo que introducir mucha imaginación y mezclar unas cuantas alocadas ideas para que todo empezara a cuadrar maravillosamente bien. El primer paso importante lo dio Niels Bohr con su modelo atómico y de ello os hablaré en nuestra historia de hoy.
Partimos del descubrimiento del electrón por parte de J.J. Thomson y del núcleo atómico por parte de Lord Rutherford. Es sabido que cargas opuestas se atraen, que el electrón tiene una carga negativa y el protón una positiva. ¿Por qué no se precipita entonces el electrón contra el protón en el átomo? Bien, había que hacer un modelo para explicar su funcionamiento.
Rutherford sugirió el modelo planetario. Propuso que los átomos eran como pequeños sistemas solares donde el núcleo ocupaba el puesto que le correspondería al Sol y los electrones orbitaban como si fueran planetas.
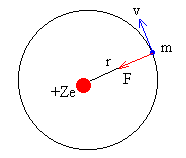
Este modelo está muy bien porque explicaría, a priori, que el electrón no tiene por qué precipitarse contra el núcleo. Sin embargo, había una cosa que no cuadraba. Estaba comprobadísimo que una carga acelerada emite energía. Eso es lo que ocurre en las antenas emisoras: las cargas se aceleran a lo largo de ella arriba y abajo emitiendo señales (energía). Como en el modelo planetario el electrón se movía en órbitas circulares (o elípticas) y el movimiento circular es acelerado, el electrón tendría que ir emitiendo radiación, perdiendo energía y disminuyendo el radio de su órbita hasta chocar finalmente con el núcleo. Y esto debía suceder en un tiempo ínfimo. Así que el modelo planetario junto a las leyes de Maxwell predice que el Universo colapsaría en casi un instante. Descartemos el modelo, aunque sea, por nuestra propia existencia.
Pero había más cosas que fallaban. Si hiciéramos colisionar un planeta con otro similar, el sistema quedaría bastante maltrecho y no sería el mismo que antes de la colisión. Si los átomos fueran realmente sistemas planetarios serían igual de perturbables frente a las colisiones y otros factores externos. Sabemos que los átomos bombardeados o calentados (hasta cierto punto), no sufren ninguna modificación. Por ejemplo, sabemos que en un gas los átomos que lo componen están sufriendo colisiones a razón de varios millones de veces por segundo y no por ello dejan de ser idénticos. Si realmente los electrones girasen en órbitas planetarias, sus electrones podrían tener distancias arbitrarias respecto el núcleo (en función de su velocidad orbital), con lo que dos átomos en teoría iguales con electrones girando en diferentes órbitas serían diferentes entre sí y tendrían comportamientos químicos diferentes.
Y otro fallo importante de este modelo es que no explicaba los espectros que eran bien conocidos por aquella época. La luz o energía emitida por un átomo lo hace en unas longitudes de onda muy peculiares y hacen las veces de huella digital del elemento. Eran muy conocidas las líneas del espectro del hidrógeno (la de bajo en la imagen siguiente).
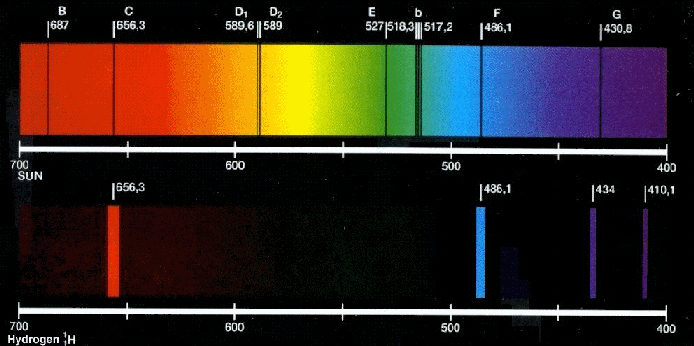
Esas huellas que veis son del espectro visible y están situadas a 410 nm, 434 nm, 486 nm y 656 nm. El primero que estudió esas líneas del hidrógeno fue Johann Jakob Balmer (por cierto, un cráter en la Luna lleva su nombre). Después de mirar y remirar a base de prueba y error dio con una fórmula que las predecía de forma asombrosamente exacta:
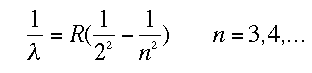
Esa R era la constante de Rydberg. Cuando los físicos empezaron a observar partes no visibles del espectro se dieron cuenta que la fórmula que había dado Balmer para el visible se parecía mucho a las deducidas en este lado no visible. Se trataba de las fórmulas de Lyman y Paschen:
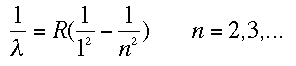
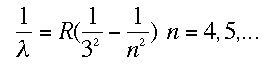
Pues bien, el modelo planetario de Rutherford tampoco decía nada de estos espectros. Aquí entra en escena un joven que había venido a ayudar a Rutherford. Este último dijo que “había venido para adquirir alguna experiencia”. Y vaya, si la adquirió. El alumno resultó ser uno de los más grandes en la historia de la física. Era, por supuesto, Niels Bohr.
Esta es una de esas curiosas ocasiones de la historia en que están las ideas en el aire y llega un hombre que las une para formar una nueva teoría. Bohr pensó en hacer un modelo atómico empezando por el hidrógeno, el más sencillo, con un protón en el núcleo. Tomó el modelo planetario de Rutherford y el principio de de Broglie. Si el electrón era una onda, en lugar de ir dando vueltas como los planetas lo hacen alrededor del Sol se iría moviendo con sus picos y sus valles de modo que el final de un ciclo encajara con otro formando una onda estacionaria. Si no fuera así, la onda podría interferir consigo misma incluso tener una interferencia destructiva y desaparecer.
Las longitudes de onda tienen una determinada distancia entre sus picos y si el final de una tiene que coincidir con el principio de la otra, el tamaño de la órbita está definido y no puede tener cualquier valor. El valor de la longitud de la circunferencia descrita es un número entero de veces esa longitud de onda:
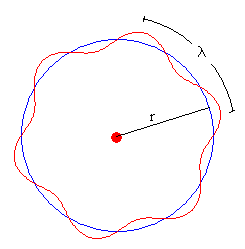
Por tanto, si los radios estaban fijos e iban en función de un número entero “n” que era el número de veces la longitud de onda asociada a esa partícula, los radios estaban “cuantizados” y ese “n” era un número “cuántico”. Dijo, además, que cuando los electrones se situaban de esta manera no emitían energía y que el átomo sólo lo hacía cuando un electrón saltaba de una órbita superior a una inferior.
Me explico, en el estado fundamental, o sea, el de más baja energía, el electrón está en el primer nivel (n=1). Si le comunicamos energía, por ejemplo, calentándolo, el electrón puede subir a otros niveles mayores (n=2,3,…). Ahora puede desexcitarse y bajar de nivel y al hacerlo hay un exceso de energía sobrante que emite en forma de fotón. Si ese fotón da la casualidad que entra en el visible tendremos un destello de luz.
Partiendo de estas hipótesis, lo único que tenía que hacer era plasmarlo matemáticamente y cuando lo hizo se encontró la ecuación siguiente:
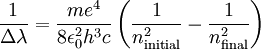
![]()
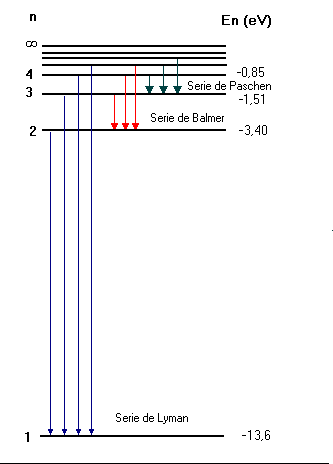
Aparte de reproducir las fórmulas Balmer, Lyman y Paschen reproducía el valor de la constante de Rydberg a partir de otras constantes fundamentales de la Naturaleza. Las líneas espectrales quedaban de la siguiente manera:
n inicial = 1: serie de Lyman
n inicial = 2: serie de Balmer
n inicial = 3: serie de Paschen
n inicial = 4: serie de Brackett
n inicial = 5: serie de Pfund
n inicial = 6: serie de Humphreys
Que una serie de hipótesis tan descabelladas reproduzcan unas observaciones experimentales tan concretas es para sorprenderse. Recordaré toda mi vida el día que me lo explicaron. Al finalizar, el profesor hizo un breve suspiro y tras unos instantes de silencio dijo: “Y aquí es donde se ve que la ciencia es un arte. A ver, Mozart fue un gran músico, ¿no?, tocaba el piano desde niño, ¿no? Pues … ¡chapeau!. Al tío al que se le ocurrió esto … ¡chapeau!”
De Hevesy nos contaba que tuvo que explicar todo esto a Albert Einstein. El gran hombre atendió a toda la explicación y cuando le dijo que los espectros del hidrógeno predichos por el modelo coincidían exactamente con los observados experimentalmente, los ojos de Einstein parecían más grandes de lo que ya eran. Einstein respondió:
- Entonces, es uno de los más grandes descubrimientos.
Rutherford presionó a Bohr para que publicara todas estas ideas. Bohr le dijo:
- No puedo. Nadie me creerá hasta que haga todos los átomos y todas las moléculas.
- Bohr, haz el hidrógeno y el helio y todo el mundo se creerá el resto – replicó Rutherford.
Bohr no solo fue grande como físico, sino como persona. Ya os comenté que fue un gran maestro y que su hermano y él jugaron en la selección danesa de fútbol en los juegos olímpicos de Londres de 1908 donde metieron 17-1 a Francia. Bueno, puede que nuestro héroe no fuera Ronaldinho pero se cuenta que mientras paseaba por las calles de Copenhague en compañía de un físico extranjero, muchos transeúntes lo saludaban calurosamente. Cuando el físico le preguntó cuál era la razón contestó que era por las fintas que hacía llevando la camiseta del equipo local.
En el Instituto de Copenhague organizó la ayuda y el soporte a todos los científicos refugiados que querían huir de la Alemania nazi. Muchos de esos refugiados prosiguieron con él en sus investigaciones. Cuando Dinamarca fue tomada por los alemanes en abril de 1940 se puso en contacto con la resistencia danesa y protagonizó una famosa huida a EEUU vía Suecia y Gran Bretaña. Una vez en los Álamos trabajó en la puesta a punto de la bomba atómica, pero no por espíritu bélico, sino porque pensaba, como todos, que era una necesidad.
Fue, además, uno de los primeros en adquirir conciencia de que la física atómica iba a jugar un papel decisivo en la historia de la humanidad. Emprendió él solo la tarea de enfrentarse a los grandes dirigentes para persuadirles de que debía existir una estrecha colaboración entre Este y Oeste y así crear un mundo mucho más abierto. Se reunió para ello con Roosevelt y Churchill. Ya se sabe lo que sucedió: Churchill le encontró sospechoso de “ser un poco demasiado complaciente con los soviéticos”.
Después de la guerra intentó sin descanso alertar a todos los políticos de los peligros de una carrera armamentística y puso todo su empeño en unir a los científicos de todos los países. Uno de sus más conocidos legados es el Centro Europeo de Investigación Nuclear (el CERN) en Ginebra, donde tantos descubrimientos han hecho en la era moderna.
Fuentes:
“La revolución cuántica”, Victor Weisskopf
“El secreto de la química”, Gianni Fochi
“The making of the atomic bomb”, Richard Rhodes
http://es.wikipedia.org/wiki/Modelo_de_Bohr
http://www.sc.ehu.es/sbweb/fisica/elecmagnet/movimiento/bohr/bohr.htm
http://www.inicia.es/de/atomos/modelos2.html











El día 7 de diciembre de 2006 a las 10:11
Buenísimo! Me acabo de leer “introducción a la ciencia” de Asimov, y mira que está mal explicado! Me ha gustado mucho la exposición.
1 saludo, y gracias por el blog.
El día 7 de diciembre de 2006 a las 10:16
Gracias ESE. No obstante, Asimov es un gran divulgador y quiero pensar que el fallo estará más en la traducción que no en el original.
Salud!
El día 7 de diciembre de 2006 a las 12:37
gran explicación, pero sigo sin entender porque si el electron sigue una trayectoria en forma de onda alrededor del nucleo del atomo no desprende energía, porque a priori es un movimiento acelerado tb no?
El día 7 de diciembre de 2006 a las 13:12
Con tu permiso, enlazaré esta amena y precisa explicación del Modelo de Bohr. Nadie hasta ahora me lo había explicado tan clara y sencillamente. Enhorabuena por la capacidad pedagógica: si yo lo he entendido, puede entenderlo cualquiera.
El día 7 de diciembre de 2006 a las 14:18
Hugo: el modelo de Bohr no es el que actualmente se tiene, pero da una idea muy aproximada. En realidad, el eletrón no sigue una “trayectoria”. Si te fijas en el artículo de la doble rendija, http://www.historiasdelaciencia.com/?p=78 verás que no sabíamos por el agujero que había pasado. En cuántica desaparece el concepto “trayectoria”. En el momento que Bohr dijo todo esto, su forma de explicarlo fue decir que era una onda estacionaria, como la que haría una guitarra al sonar, sin pérdida de enrgía por rozamientos. Insisto, que no es un modelo exacto del todo, pero sí muy aproximado. Espero haberte contestado.
fernando mh: gracias, más que por el enlace, por el elogio.
Salud!
El día 7 de diciembre de 2006 a las 23:32
Una preguntilla omalaled. En:
“n final = 1: serie de Lyman
n final = 2: serie de Balmer
n final = 3: serie de Paschen
n final = 4: serie de Brackett
n final = 5: serie de Pfund
n final = 6: serie de Humphreys”
no debería ser n inicial?
El día 7 de diciembre de 2006 a las 23:38
Por cierto, ¿al final hizo también el del Helio?
El día 7 de diciembre de 2006 a las 23:53
epidimo: ¡Arrrgggg! ¡tienes razón! ¡es n inicial! Me revelo contra no meter la pata, al menos, una vez por artículo
Lo del helio. Que yo sepa no. El modelo de Bohr es perfectamente generalizable a los iones hidrogenoides, o sea, los que han perdido todos los electrones menos uno.
El helio, si le falta un electrón, es un átomo hidrogenoide; pero para modelar el átomo de helio con dos electrones hay que tener en cuenta la interacción de uno con el otro. Y no es trivial. Que yo sepa, no lo hizo o, al menos, no lo he leído por ninguna parte.
Salud!
El día 8 de diciembre de 2006 a las 06:57
Desde el helio en adelante el modelo se complica por el principio de exclusión de Pauli, que agrega más números cuánticos y que de nuevo no pueden ser iguales todos (al menos el spin debe ser diferente), el modelo de Bohr introduce el número cuántico principal (n), pero hay que tener en cuenta el resto. .
.
Pero eso Omalaled nos lo explicará en otra ocasión
Recuerdo que en el instituto (y aún hoy en día es igual), se “explicaban” los números cuánticos, por las formulas típicas (nada difíciles), sin tener la más remota idea de a que nos referíamos o por qué era así, los orbitales y suborbitales igual, tampoco se tenía en cuenta por qué aveces un orbital estaba antes que un suborbital. :-S
El día 10 de diciembre de 2006 a las 00:46
Prometo algún día explicar de dónde vienen esos números cuánticos. No es complejo … salvo que quieras las solución matemática. Es más larga que un día sin pan
Salud!
El día 10 de diciembre de 2006 a las 19:29
Muy buen artículo, como siempre.
Pero mira, te falta un “no”
4 párrafo comenzando por el final:
Bohr solo fue grande como físico, sino como persona.
El día 10 de diciembre de 2006 a las 23:00
Omaled tirate del rollo y haz una serie completa de fisica cuantica. Yo cada día me asombro más de como llegaron a las conclusiones, ya que muchos de sus descubrimientos son totalmente anti-intuitivos.
P.S: ¿has visto los documentales sobre la carrera espacial que pusierón en la 2? El que estaban todo el rato con la coña de: “buena perra sovietika”
El día 11 de diciembre de 2006 a las 00:32
SocJo: muchas gracias. Lo corrijo.
Nachop: ¿sabes lo que me pides? y además sin fórmulas ni duras matemáticas por medio Tengo algunos reservados que a buen seguro te gustarán. Estás ávido de ciencia
Tengo algunos reservados que a buen seguro te gustarán. Estás ávido de ciencia 
Y sí, vi algún documental. Muy bueno. Lástima que no pongan más por TV.
Salud!
El día 14 de diciembre de 2006 a las 15:04
No, Omalaled, lo tenias bien al principio. Las “n” de las series espectrales del hidrogeno son “n final”. Mira el sentido de las flechas que tu mismo has puesto en un diagrama en el articulo…
Permiteme explicarlo un poco para todos. Como estamos hablando de espectros de emision, la luz se produce cuando un electron que esta en un estado excitado (porque hemos calentado el gas, por ejemplo) “cae” de un nivel de energia mas alto a uno mas bajo. Asi, la serie de Lyman es la que se observa cuando electrones pasan de estar con n iniciales mayores de 1 al estado final con n=1.
Por cierto, chiste malo del dia: cual es el ruido que hace un electron al pasar de un nivel de energia a otro? Planck!
(Lo se, merzco la horca…)
El día 14 de diciembre de 2006 a las 16:59
Esteee… ni caso a mi comentario anterior. No me habia fijado en los subindices del formulote que tenias antes de donde nombras todas las series. Para ser coherentes con ellos, esta bien como lo tienes ahora.
Perdon por la ida de pinza y por dar la brasa para nada…
El día 14 de diciembre de 2006 a las 23:26
Tranqui, Saul: a mí me pasó lo mismo que a ti. En realidad los índices son mudos, pero quería mucho más claro si donde pone inicial pusiera final y viceversa en todas partes, como afirmas.
Me alegra ver que te has mirado las fórmulas
Salud!